ATOMI MOLI UOVA E FRITTATE
Partiamo da tre definizioni:
| Il numero di Avogadro 6,02X1023 è il numero di atomi (o molecole o unità formula) presente in una quantità di un qualunque elemento o composto corrispondente al valore della massa atomica (o molecolare o formula) relativa espressa in grammi |
| Una mole è la quantità, espressa in grammi, di un qualunque elemento o composto, contenente un numero di Avogadro di atomi (molecole o unità formula) |
| Ma anche: una mole di un elemento o di un composto corrisponde alla massa atomica relativa, alla massa molecolare relativa o alla massa formula relativa, espressa in grammi. |
Di cosa stiamo parlando? Per capirlo possiamo partire da un esempio forse più familiare.
Una dozzina di uova contiene sempre lo stesso numero di pezzi, sia che si tratti di uova di gallina, uova di quaglia o uova di struzzo. Naturalmente, anche se una dozzina di uova ne contiene sempre lo stesso numero,dodici, il peso di una dozzina di uova dipenderà dal tipo di uova di cui stiamo parlando. 12 uova di gallina peseranno senza dubbio più di 12 uova di quaglia, mentre 12 uova di colibrì (sempre che riusciate a trovarne) peseranno molto meno. 12 uova di struzzo poi avranno un peso migliaia di volte superiore alle 12 uova di colibrì  
|
 dozzina di uova di gallina  dozzina di uova di quaglia |
Ora, se un uovo di quaglia pesa esattamente un terzo di un uovo di gallina, questa proporzione sarà mantenuta anche per una dozzina.
Cioè anche una dozzina di uova di quaglia peserà esattamente un terzo di una dozzina di uova di gallina.
Questo succede perché per passare da "uovo" a "dozzina" si moltiplica sempre per lo stesso numero, cioè 12, quindi la differenza in percentuale è la stessa per un uovo, 12 uova o 100 dozzine di uova, cioè 1200 uova.
1200 uova (100 dozzine) di quaglia peseranno esattamente un terzo di 1200 uova di gallina.
Naturalmente se voglio sapere quanto pesa realmente una dozzina di uova di gallina devo sapere quanto pesa mediamente un singolo uovo.
|
Bene. Adesso sostituite al termine "dozzina" il termine "mole" e al numero "12" (unità presenti in una dozzina), il numero 6,02X1023 (unità presenti in una mole). Invece di pensare a uova di colibrì, di quaglia e di gallina, pensate ad atomi di idrogeno, carbonio o potassio. |
Dalla tavola periodica già sappiamo che ad esempio che un atomo di idrogeno (massa relativa=1) pesa esattamente 1/12 di un atomo di carbonio (massa relativa=12), anche una mole di atomi di idrogeno peserà esattamente 1/12 di una mole di carbonio (così come una dozzina di uova di quaglia pesa sempre un terzo di una dozzina di uova di gallina)
Non solo, ma il numero di avogadro non è stato scelto a caso, infatti un atomo di carbonio pesa (massa assoluta) 1,9926x10-23 grammi e se io moltiplico il vero peso di un atomo di carbonio per il numero di avogadro (1,9926x10-23 x 6,02X1023) ottengo un numero intero, 12 grammi. Poiché la massa relativa di tutti gli atomi è stata definita appunto in funzione di un dodicesimo della massa dell'isotopo 12 del carbonio (che corrisponde a una uma), questo giochino vale per tutti gli atomi. Moltiplicando il vero peso di un atomo di idrogeno per il numero di Avogadro si ottiene esattamente 1 grammo, sa fate la stessa cosa per l'atomo di ossigeno il risultato è 16 grammi e così via. |
 |
| UNA PRECISAZIONE: Naturalmente nella realtà bisogna tenere conto anche della presenza degli isotopi. Se infatti osservate con attenzione la tavola periodica vedrete che la massa relativa dell'atomo di carbonio è 12,01. Questo succede perchè in natura una piccola percentuale di atomi di carbonio possiede due neutroni in più, sono cioè atomi di 14C (carbonio quattordici). Nei miilardi e miliardi di atomi che costituiscono una mole sarà sempre presente una percentuale di isotopi per cui la massa relativa non corrisponde esattamente al numero di massa, ma è la media del peso di tutti gli isotopi presenti nelle loro quantità pecentuali. Nella pratica di laboratorio comunque è di solito sufficiente approssimare il peso di una mole al numero intero. |
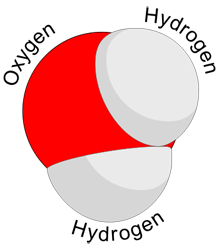 |
Una volta stabilito che 6,02X1023 atomi di un qualsiasi elemento costituiscono una massa pari alla sua massa relativa espressa in grammi, possiamo calcolare anche quanto pesa una mole di un composto. Una mole di acqua conterrà 6,02X1023 molecole, per ogni molecola di acqua avremo un atomo di ossigeno e due di idrogeno ci saranno quindi una mole di ossigeno (6,02X1023 atomi di O =16g) e due moli di idrogeno (2x6,02X1023 atomi di H=2g), totale 18g. Una mole di acqua, contiene 6,02X1023 molecole e pesa 18g. |
Bene, ora possiamo passare a qualche esercizio, cliccate qui ![]()

