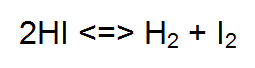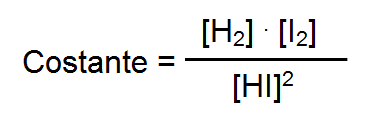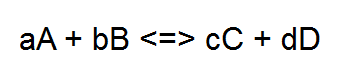|
L'EQUILIBRIO CHIMICO Nella vita quotidiana abbiamo a che fare continuamente con un numero enorme di reazioni chimiche. Alcune di queste reazioni possiamo vederle avvenire sotto i nostri occhi e possiamo renderci conto di quanto avvengano velocemente e se siano o no irreversibili, mentre per altre è un po' più difficile.
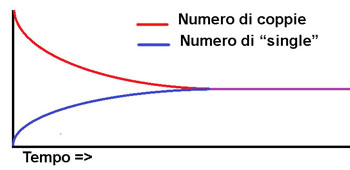
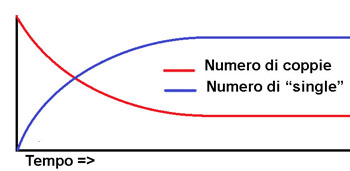
La reazione chimica grazie alla quale ricarichiamo la batteria del nostro cellulare avviene lentamente ed è reversibile (avvenendo al contrario fornirà energia elettrica anziché assorbirla). Il fiammifero brucia con una reazione irreversibile che avviene in modo relativamente lento, mentre nell'esplosione di una bomba i reagenti (di solito solidi) si trasformano in una enorme quantità di gas ad alta temperatura in pochi millesimi di secondo. In generale una reazione irreversibile si può rappresentare in questo modo: Reagenti => Prodotti (o, per essere più precisi) aA + bB => cC + dD mentre una reazione reversibile si rappresenterà Reagenti <=> Prodotti (o, per essere più precisi) aA + bB <=> cC + dD Dove: A, B, C e D rappresentano delle generiche sostanze (A e B reagenti, C e D prodotti) e a, b, c e d i loro In questo secondo caso non è detto che tutti i reagenti si trasformino in prodotti. Ad un certo punto la velocità con cui avviene la reazione inversa, cioè i prodotti C e D che si "ritrasformano" nei reagenti A e B, eguaglerà la reazione diretta (A e B che si trasformano in C e D).  Immaginate un ballo studentesco degli anni '50. Per movimentare la serata il disc jockey (forse non esistevano i disc jockey negli anni '50..) mette su un gioco per cui le coppie, una alla volta si "scoppiano" e il ragazzo e la ragazza devono cercarsi un altro ballerino. All'inizio quando solo poche coppie si saranno divise, sarà difficile trovare qualcuno libero con cui ballare nel grande salone affollato. In questa prima fase il numero di coppie che stanno ballando diminuirà sensibilmente, mentre aumenterà il numero di ragazzi e ragazze da soli che cercano qualcuno con cui ballare. Quando però molte coppie si saranno separate inizieranno ad esserci tante persone "single" e nuove coppie inizieranno a formarsi. Ad un certo punto il numero di coppie che si formano diventerà uguale a quelle che si separano e la situazione nella grande sala da ballo raggiungerà un equilibrio. Ci saranno un certo numero di coppie che ballano da un po' e si stanno per separare, un certo numero di ragazzi e ragazze da soli che cercano qualcuno con cui ballare e un certo numero di coppie appena formate che stanno iniziando a ballare.
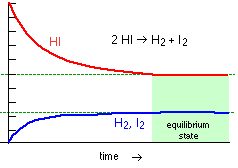
SOSTITUIAMO AI BALLERINI ATOMI E MOLECOLE Vediamo un il caso di una reale reazione chimica: Lo ioduro di idrogeno HI in fase gassosa si scinde in molecole di idrogeno H2 e di Iodio I2 la reazione bilanciata è la seguente 2HI <=> H2 + I2
Un matematico e un chimico (Cato Guldberg e Peter Waage) lavorando insieme, scoprirono che una volta raggiunto l'equilibrio si stabiliva un rapporto costante tra la concentrazione dei prodotti e quella dei reagenti. In particolare per la reazione:
esso è
Questa ed altre osservazioni hanno portato ad enunciare una legge della chimica, la legge di azione di massa. In generale per la reazione:
la costante di equilibrio Keq è data da:
Ecco l'enunciato
|


 coefficienti stechiometrici
coefficienti stechiometrici