|
LA TAVOLA PERIODICA
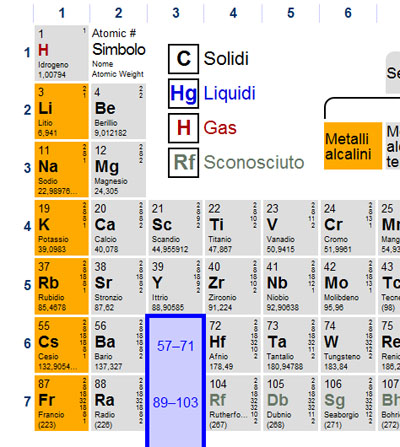
È giunto il momento di prendere confidenza con la tavola periodica. Come sicuramente avete già intuito gli elementi chimici non sono riportati a caso nella tavola periodica, infatti in base alla loro posizione è possibile prevedere quali saranno le loro caratteristiche e come si comporteranno in determinate condizioni.
Per il momento partiamo dal concetto che ogni RIGA della tavola periodica costituisce un PERIODO, mentre ogni COLONNA costituisce un GRUPPO.
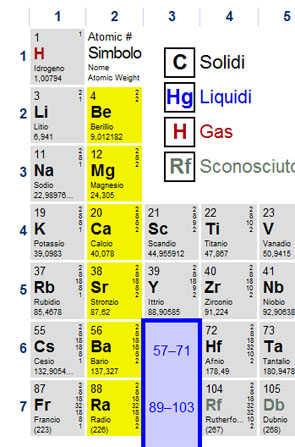
Le proprietà e soprattutto il comportamento degli elementi variano scorrendo da sinistra a destra (o viceversa) lungo un periodo, mentre gli elementi presenti in una colonna (o gruppo) avranno un comportamento simile. Iprincipali gruppi che dovete saper riconoscere sulla tavola periodica sono i METALLI ALCALINI, i METALLI ALCALINO TERROSI, gli ALOGENI e i GAS NOBILI. Dovete inoltre essere in grado di distinguere i METALLI dai NON METALLI e (solo per i più secchioni) anche i SEMIMETALLI.
Oltre alla vostra inseparabile tavola periodica che porterete con voi ogni volta che c'è chimica, può essere molto utile questo sito internet che vi invito a visitare e ad esplorare.
https://ptable.com/
METALLI

Nella
tavola periodica che vedete qui sopra sono evidenziati con i colori tutti i metalli, mentre i non metalli sono lasciati in grigio.
Possiamo vedere che i metalli occupano in pratica tutta la parte sinistra della tavola periodica. In genere hanno una bassa
 elettronegatività, specialmente quelli posizionati più a sinistra (essi infatti non hanno nessun interesse ad attirare elettroni, ma anzi cercano di "disfarsene" per raggiungere l'ottimale configurazione ad ottetto). Per lo stesso motivo il loro elettronegatività, specialmente quelli posizionati più a sinistra (essi infatti non hanno nessun interesse ad attirare elettroni, ma anzi cercano di "disfarsene" per raggiungere l'ottimale configurazione ad ottetto). Per lo stesso motivo il loro  numero di ossidazione è sempre positivo e quando formano degli numero di ossidazione è sempre positivo e quando formano degli  ioni formano sempre ioni positivi ( o cationi). ioni formano sempre ioni positivi ( o cationi).
Molti metalli hanno più numeri di ossidazione e possono formare composti diversi con lo stesso elemento, ad esempio il ferro può avere numero di ossidazione +2 (con l'ossigeno forma FeO) oppure +3 (con l'ossigeno forma Fe2O3)
I metalli si dividono in vari gruppi; metalli di post transizione, metalli del gruppo d (si chiamano così come avrete senza dubbio immaginato perché riempiono, nella loro configurazione elettronica anche uno o più orbitali d), lantanidi, attinidi, metalli alcalino terrosi e metalli alcalini. Cercate di ricordare questi due ultimi gruppi.
 |
METALLI ALCALINI
Litio (Li)
Sodio (Na)
Potassio (K)
Rubidio (Rb)
Cesio (Cs)
Francio (Fr)
Possiedono
un solo elettrone nei loro obitali o gusci di  valenza che è sempre un orbitale n s1. Il loro numero di ossidazione è sempre +1 e formano sempre ioni positivi di carica 1+. valenza che è sempre un orbitale n s1. Il loro numero di ossidazione è sempre +1 e formano sempre ioni positivi di carica 1+. |
METALLI ALCALINO TERROSI
Berillio (Be)
Magnesio (Mg)
Calcio (Ca)
Stronzio (Sr)
Bario (Ba)
Radio (Ra)
La loro configurazione elettronica negli orbitali più esterni finisce sempre con un orbitale n s2. Possiedono 2 elettroni di valenza e il loro numero di ossidazione è in pratica sempre +2. Formano ioni positivi di carica 2+.
|
|
SEMIMETALLI
Come si può intuire dal nome si tratta di elementi che hanno caratteristiche intermedie tra i metalli e i non metalli, si tratta in partica di soli sette elementi: Boro, Silicio, Germanio, Arsenico, Antimonio, Tellurio e Polonio.
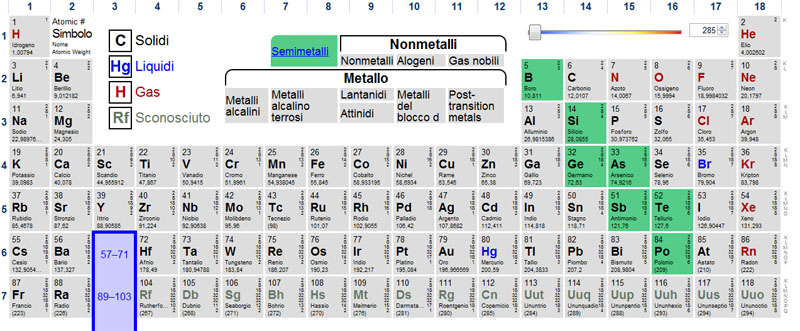
NON METALLI
Quelli evidenziati con i colori qui sopra sono invece i non metalli, come vedete sono decisamente in minoranza rispetto ai metalli.
Quattro tra questi elementi sono basilari per noi esseri viventi, idrogeno, carbonio, azoto e ossigeno costituiscono la maggior parte delle molecole organiche, il nostro corpo ad esempio è formato in gran parte proprio da questi quattro elementi.
L'ossigeno e l'idrogeno sono tra i più reattivi elementi anche nella chimica inorganica ed entrano in un gran numero di composti.
IDROGENO
Avendo un solo elettrone c'è poco da scegliere! La 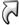 valenza dell'idrogeno è sempre 1, ma il suo valenza dell'idrogeno è sempre 1, ma il suo 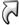 numero di ossidazione può essere +1 o -1. Nella maggior parte dei casi l'idrogeno "cede" il suo elettrone ad atomi più elettronegativi, in questo caso il numero di ossidazione è +1 (es. HCl acido cloridrico, H2O acqua, HNO3 acido nitrico). Quando si combina con i metalli l'idrogeno assume numero di ossidazione negativo, cioè diciamo che "accetta" o "riceve" dai metalli un elettrone (es. NaH idruro di sodio, AlH3 idruro di alluminio) numero di ossidazione può essere +1 o -1. Nella maggior parte dei casi l'idrogeno "cede" il suo elettrone ad atomi più elettronegativi, in questo caso il numero di ossidazione è +1 (es. HCl acido cloridrico, H2O acqua, HNO3 acido nitrico). Quando si combina con i metalli l'idrogeno assume numero di ossidazione negativo, cioè diciamo che "accetta" o "riceve" dai metalli un elettrone (es. NaH idruro di sodio, AlH3 idruro di alluminio)
OSSIGENO
L'ossigeno è un elemento che si da molto da fare, è estremamente reattivo e può combinarsi con quasi tutti gli altri elementi della tavola periodica. Ha un alto valore di elettronegatività (solo il fluoro è più elettronegativo) e spesso fa il prepotente strappando elettroni (tipicamente due) agli altri atomi. Quando succede infatti si dice che l'elemento è stato ossidato, questa definizione "ossidazione" si usa anche quando non è l'ossigeno a strappare elettroni. La cosa ci riguarda da vicino perché se stai leggendo questa pagina e rimani in vita lo devi all'ossigeno che proprio in questo momento sta ossidando le sostanze che hai mangiato a cena o a colazione e fornisce così energia al tuo organismo.
Il numero di ossidazione dell'ossigeno è quasi sempre -2 tranne nei perossidi in cui è -1 (come in H2O2)
Tra i non metalli da ricordare sono gli alogeni e i gas nobili
ALOGENI
Fluoro (F)
Cloro (Cl)
Bromo (Br)
Iodio (I)
Astato (At)
Sono tutti atomi molto elettronegativi, cioè hanno una forte capacità di attirare elettroni. Il fluoro a sempre numero di ossidazione -1, questo significa che "cerca disperatamente" qualcuno a cui "rubare" un elettrone. Il motivo è semplice da capire: al fluoro con i suoi 9 elettroni ne basta appunto uno per arrivare al sospirato ottetto (configurazione del Neon). Gli altri alogeni hanno tutti numero di ossidazione -1, ma possono avere anche numeri di ossidazione positivi. |
 |
| Ad esempio il cloro può rubare un elettrone a qualcuno (come al sodio) e raggiungere così l'ottetto, ma può anche provare a cedere uno o più dei suoi elettroni per cercare di raggiungere la configurazione del neon. Esso quindi può assumere come numero di ossidazione i valori +1, +3, +5, +7. La stessa cosa vale anche per gli altri alogeni. |
|
GAS NOBILI
Elio (He)
Neon (Ne)
Argon (Ar)
Kripton (Kr)
Xenon (Xe)
Radon (Rn)
Che dire dei gas nobili? Sono elementi baciati dalla fortuna, come dire, nati con la camicia. Il loro ottetto è già completo e i loro orbitali esterni comprendono sempre otto elettroni (2 nell'orbitale s e 6 nell'orbitale p). Non dovendo mai nè cedere nè acquistare elettroni non prendono parte a legami o reazioni chimiche. Dei tipi decisamente asociali!
(anche se in realtà come abbiamo visto ci sono delle eccezioni) |
QUAL E' IL CONCETTO?
Ogni atomo cerca di raggiungere una configurazione elettronica uguale o almeno vicina a quella dei gas nobili. Per farlo gli atomi devono quasi sempre farsi prestare o mettere in compartecipazione o disfarsi di uno o più elettroni. Quando si forma un legame chimico tra due elementi significa che in qualche modo sui loro orbitali esterni succede qualcosa che li porta a essere uguali o almeno ad assomigliare a un gas nobile.
|






