COME CAVOLO SI CHIAMA?
GUIDA SPEDITIVA ALL'INDIVIDUAZIONE DEL NOME DI UN COMPOSTO CHIMICO INORGANICO (Per la chimica organica ci attrezzeremo)
 |
AVETE IL NOME E NON CONOSCETE LA FORMULA? |
Per gli studenti che per la prima volta si avventurano nello sterminato, e piuttosto complicato, campo della nomenclatura chimica, può non essere facile orientarsi e impadronirsi in breve tempo delle competenze necessarie per arrivare a determinare formula e nome dei composti.
Le cose sono anche complicate dal fatto che esistono più modi di assegare i nomi ai composti chimici. Il "nome ufficiale" è il nome IUPAC. La IUPAC, acronimo di International Union of Pure and Applied Chemistry (in italiano Unione Internazionale di Chimica Pura ed Applicata), è una organizzazione non governativa che si occupa, tra le altre cose, di stabilire in modo univoco e semplice, i nomi per tutte le sostanze chimiche. La nomenclatura adottata dalla IUPAC è semplice e razionale e identifica i composti a prescindere dalla loro caratteristiche.
Esempi:
|
Per alcuni composti come gli ossoacidi e i sali di ossoacidi, la nomencaltura tradizionale, che si basa su desinenze e prefissi assegnati in base al numero di ossidazione, è ancora molto usata ed è quindi molto utile conoscerla.
Nel caso di composti binari o di ossoacidi, quando un elemento, come ad esempio un catione metallico, compare con due numeri di ossidazione, si assegna la desinenza oso quando l'elemento si presenta con il suo numero di ossidazione minore, mentre si assegna la desinenza ico, quando presenta il numero di ossidazione maggiore. Ad esempio: FeO (num. ossidaz. del ferro +2) ossido ferroso Qualche volta le cose sono un po' più complicate perché un elemento può presentare anche più di due numeri di ossidazione. In questi casi oltre alle desinenze oso e ico si aggiunge un prefisso ipo + desinenza oso per il numero di ossidazione in assoluto più piccolo e un prefisso per + desinenza ico per il numero di ossidazione in assoluto più grande. Ad esempio: Cl2O (num. di ossidaz del cloro +1) anidride ipoclorosa Se ad un ossido acido (ossigeno + non metallo) si aggiunge una molecola d'acqua si ottiene un ossoacido. Ad esempio: H2O + Cl2O => 2 HClO, in questo caso si usano stessi prefissi e desinenze. HClO acido ipocloroso (numero di ossidazione del cloro +1) In generale negli ioni poliatomici derivanti da ossoacidi e nei sali si assegna la desinenza in ato quando l'elemento coinvolto presenta numero di ossidazione maggiore, ito, quando presenta numero di ossidazione minore. Se un elemento presenta più di due numeri di ossidazione si usa il suffisso per + desinanza ato per quello più alto in assoluto e il suffisso ipo + desinenza ito per quello più basso in assoluto. In pratica oso si trasforma in ito e ico si trasforma in ato. Ad esempio il cloro può formare quattro ioni poliatomici: ClO- ione ipoclorito (numero di ossidazione del cloro +1) che danno sali legandosi a cationi metallici NaClO ipoclorito di sodio (numero di ossidazione del cloro +1)
|
|
Per non farsi mancare nulle, esiste un altro sistema di nomenclatura che è la notazione di Stock. Si tratta di un metodo per evitare l'uso, talvolta scomodo, dei prefissi numerici o dei nomi tradizionali. Secondo tale notazione, subito dopo il nome dell'elemento che ha numero di ossidazione variabile, si indica il suo numero di ossidazione in numeri romani tra parentesi. Il segno meno si riporta solo se il numero di ossidazione è negativo. Ad esempio: Fe2O3 ossido di ferro (III)
|
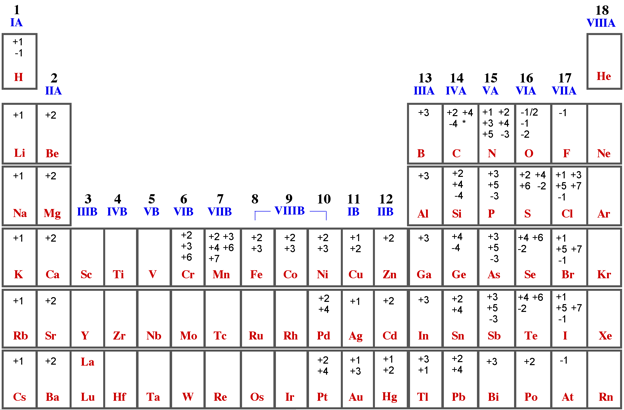
Tabella dei principali numeri di ossidazione.
In queste pagine è possibile trovare una guida speditiva (e un po' semplificata) per arrivare a determinare il nome del composto partendo dalla formula.
In pratica useremo delle ![]() chiavi dicotomiche , che non sono pericolosi ordigni nucleari, ma dei semplici criteri per distinguere, partendo da un ampio gruppo iniziale, gruppi via via più ristretti di elementi fino a giungere appunto ad una loro classificazione.
chiavi dicotomiche , che non sono pericolosi ordigni nucleari, ma dei semplici criteri per distinguere, partendo da un ampio gruppo iniziale, gruppi via via più ristretti di elementi fino a giungere appunto ad una loro classificazione.
Questo qui sotto è uno schema riassuntivo, per avere maggiori chiarimenti seguite il link con la grossa freccia sotto questa immagine.
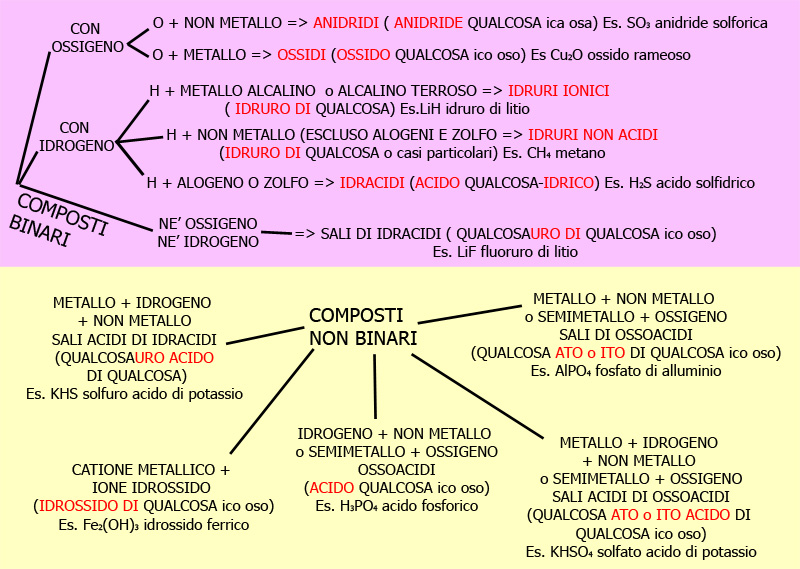
Per prima cosa dobbiamo distiguere: (cliccate sul link relativo al caso che vi interessa)
 |
AVETE IL NOME E NON CONOSCETE LA FORMULA? |
 La nomenclatura IUPAC (International Union of Pure and Applied Chemistry )
La nomenclatura IUPAC (International Union of Pure and Applied Chemistry )