|
LA CONFIGURAZIONE ELETTRONICA
| Ernest Rutherford, nel suo famoso esperimento con la lamina d'oro nel 1909 aveva scoperto che gli atomi non erano delle pallette, come pensava Dalton e neanche dei "panettoncini", come pensava Thomson. Il nucleo dell'atomo, piccolissimo rispetto alle sue dimensioni complessive, conteneva i protoni e i neutroni. Gli elettroni orbitavano, secondo Rutherford, a grande distanza dal nucleo, in modo simile ai pianeti che orbitano intorno ad una stella. Questo spiegava la grande quantità di spazio vuoto che permetteva alla maggior parte delle particelle alfa di attraversare la lamina senza deviazioni. |

Ernest Rutherford |

Niels Bohr |
Niels Bohr, un allievo di Rutherford si rese per primo conto che il modello del suo maestro non funzionava. Una carica elettrica (rappresentata dell'elettrone) sottoposta ad accelerazione emette energia sotto forma di radiazione elettromagnetica. Se l'elettrone emettesse energia finirebbe per perderla e cadere nel nucleo dell'atomo.
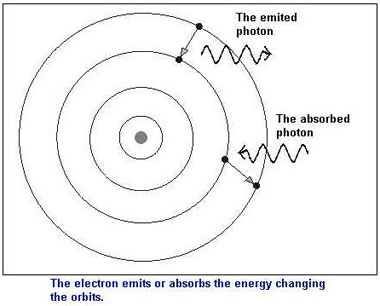
Bohr propose nel 1913 l'idea che gli elettroni potessero occupare solo determinate orbite o meglio determinati livelli di energia o stati quantici. Un elettrone può passare da un livello inferiore ad uno superiore assorbendo un fotone di energia, lo stesso fotone viene emesso quando l'elettrone passa da un livello a maggior energia ad una a minor energia. |
Gli elettroni sono obbligati a rimanere su uno dei possibili orbitali o stati quantici e non possono occupare altre posizioni. Possono solo saltare da un orbitale all'altro.
Il modello di Bohr era in accordo con la teoria dei quanti di Max Planck che proprio in quegli anni (i primi del '900) si stava affermando nella fisica.
Ecco la definizione di stato quantico (da Wikipedia)
Secondo la teoria dei quanti, uno stato quantico Ŕ un vettore definito in uno spazio di Hilbert. Data una base dello spazio formata dagli autostati di un'osservabile, uno stato pu˛ essere uno stato puro, cioŔ un vettore di base, oppure uno stato misto, cioŔ una combinazione lineare dei vettori di base. L'applicazione dell'operatore relativo all'osservabile su uno stato puro fornisce un risultato univoco, l'autovalore corrispondente, mentre l'applicazione dell'operatore su uno stato misto fornisce una distribuzione di probabilitÓ nello spazio delle fasi, usata per descrivere un ensemble di sistemi di cui non si conosce lo stato singolarmente.
Se qualcuno ci capisce qualcosa per favore me lo spieghi! |
 |

Erwin Schr÷dinger |
Uno che sicuramente aveva capito tutto fu Erwin Schr÷dinger, basandosi anche sul principio di indeterminazione di Werner Karl Heisenberg, propose che fosse impossibile determinare con precisione la posizione e la traiettoria di un elettrone (1922). Egli mise a punto delle funzioni d'onda che indicavano le zone intorno all'atomo dove era probabile che si incontrasse un elettrone.
Un orbitale quindi è semplicemente la zona di spazio intorno all'atomo dove ho almeno il 95% di probabilità di incontrare un elettrone. Ogni orbitale è contraddistinto da quattro diversi numeri quantici e si caratterizza per un ben preciso livello di energia. Gli elettroni occupano prima gli orbitali a più bassa energia e poi via via gli altri e su ogni orbitale possono coesistere solo un determinato numero di elettroni. |
 Ecco i numeri quantici di Schr÷dinger Ecco i numeri quantici di Schr÷dinger
► numero quantico principale n (è un numero che assume valori interi positivi, 1, 2, 3, 4 ...)
► numero quantico orbitale l (elle minuscolo)( indicato tradizionalmente da lettere s, p, d, f), Per ogni valore di n, il numero quantico orbitale assume in ordine crescente tutti i valori interi compresi tra 0 e n-1.
| Valore di l |
Lettera |
Massimo numero di elettroni nel sottolivello
(pari a (2 xl + 1) x 2) |
0 |
s |
2 |
1 |
p |
6 |
2 |
d |
10 |
3 |
f |
14 |
... |
... |
... |
► numero quantico magnetico ml , può assumere tutti i valori interi compresi tra - l e l
► numero quantico di spin ms , può assumere solo i valori + 1/2 e -1/2
NON POSSONO ESISTERE due elettroni che abbiano tutti e quattro i numeri quantici uguali. |
|
Vediamo di capirci qualcosa:
Prendiamo per esempio l'ossigeno che ha 8 elettroni, la sua configurazione elettronica Ŕ la seguente:
1s2 è primo orbitale (numero quantico principale =1, numero quantico orbitale =0 (che corrisponde alla lettera s), questo orbitale può contenere solo due elettroni ed è quindi completamente pieno.
2s2 è il secondo orbitale (numero quantico principale =2, numero quantico orbitale =0 (che corrisponde alla lettera s), questo orbitale può contenere solo due elettroni ed è quindi completamente pieno.
2p4 è il terzo orbitale, (numero quantico principale =2, numero quantico orbitale =1 (che corrisponde alla lettera p), questo orbitale può contenere sei elettroni e quindi non è completamente pieno avendo solo 4 elettroni.
Scrivendo tutto di seguito:
1s2 2s2 2p4
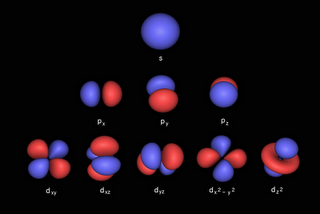
Nell'
immagine qui sopra è possibile vedere quale forma hanno gli orbitali, l'orbitale s è sferico, l'orbitale p e l'orbitale d,che posono contenere rispettivamente 6 e 10 elettroni, hanno forme più complesse, le nuvolette rappresentano la zona di spazio dove ho il 95% di probabilità di incontrare un elettrone.. |
Se volete evitare di fasciarvi troppo la testa calcolando i numeri quantici, potete seguire queste semplici regole per determinare la configurazione elettronica di un atomo:
Gli orbitali si riempiono da quelli a più bassa energia a quelli a più alta, non si può iniziare a riempire un orbitale a più alta energia se quello inferiore non è completamente pieno.
Ogni orbitale contiene un diverso numero di elettroni a seconda del numero quantico orbitale, più precismente s=2, p=6, d=10, f=14.
L'ordine con cui si riempiono gli orbitali è dato dalla così detta "regola dell'aufbau" (lo schema a destra)
|
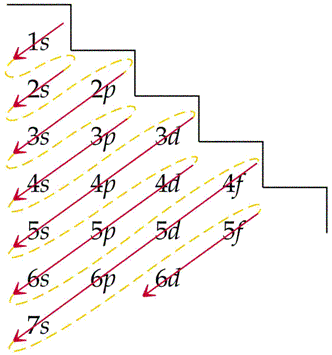 |
Ad esempio dopo aver riempito l'obitale 3p, non si passa al 3d (altrimenti era troppo facile!), ma si riempie prima il 4s (vedi andamento della freccia) e poi il 3d.

Regola dell'ottetto
Quando un atomo possiede il livello elettronico esterno completo (detto "guscio di valenza"), in genere costituito da otto elettroni, esso Ŕ in una condizione di particolare stabilitÓ energetica, e tende a non formare ulteriori legami. |
|
Per i dubbiosi ecco la configurazione elettronica dei primi atomi della tavola periodica (dall'idrogeno all'argon).
Gli atomi che nella loro configurazione hanno gli ultimi due orbitali s e p completamente pieni con 8 elettroni (2 + 6) si trovano in una situazione perticolarmente stabile, tanto che per nessun motivo sono disposti a cedere o accettare elettroni da altri atomi perché in questo modo rovinerebbero il loro "ottetto".
Si tratta dei così detti gas nobili, che si sarebbero potuti chiamare anche gas asociali o gas antipatici, perché non formano legami con nessun altro atomo e quindi non entrano in nessun composto. Per lo stesso motivo un atomo come il sodio (Na) cercherà in tutti i modi di disfarsi di un elettrone perché in questo modo potrebbe raggiungere una configurazione a "ottetto", mentre invece il cloro (Cl) cerca disperatamente qualcuno da cui farsi prestare un elettrone perché in questo modo anche lui raggiungerebbe l'ottetto.
Che succederà secondo voi quando cloro e sodio si incontrano? |
|