|
CENNI SULLA NOMENCLATURA DELLE SOSTANZE CHIMICHE
Dare il giusto nome alle migliaia di diversi composti chimici con cui i chimici (e gli studenti di chimica) hanno a che fare può apparire come un compito impossibile.
In realtà non occorre imparare a memoria migliaia di nomi astrusi, vedremo che esistono delle regole che consentono di dare ad ogni composto il giusto nome. In questa scheda faremo una semplice introduzione, anche perché ci mancano alcune importanti conoscenze come il concetto di "numero di ossidazione" che vedremo più avanti...
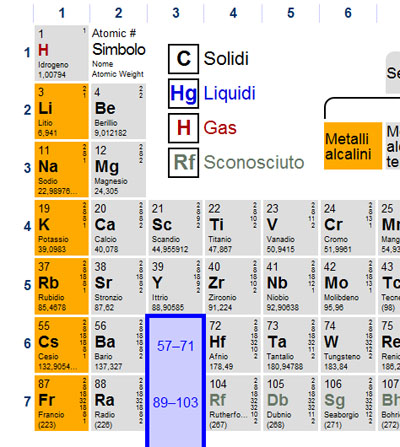
Prima di "avventurarci" nell'affascinante mondo della nomenclatura chimica è utile tenere bene a mente alcune proprietà degli elementi che si possono ben evidenziare grazie alla tavola periodica.
METALLI

Nella
tavola periodica che vedete qui sopra sono evidenziati con i colori tutti i metalli, mentre i non metalli sono lasciati in grigio.
I metalli si dividono in vari gruppi; metalli di post transizione, metalli del gruppo d (quando farete gli orbitali capirete perché si chiamano così), lantanidi, attinidi, metalli alcalino terrosi e metalli alcalini. Cercate di ricordare questi due ultimi gruppi.
 |
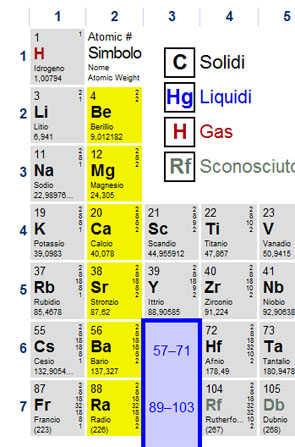
METALLI ALCALINI
Litio (Li)
Sodio (Na)
Potassio (K)
Rubidio (Rb)
Cesio (Cs)
Francio (Fr)
|
METALLI ALCALINO TERROSI
Berillio (Be)
Magnesio (Mg)
Calcio (Ca)
Stronzio (Sr)
Bario (Ba)
Radio (Ra)
|
|
SEMIMETALLI
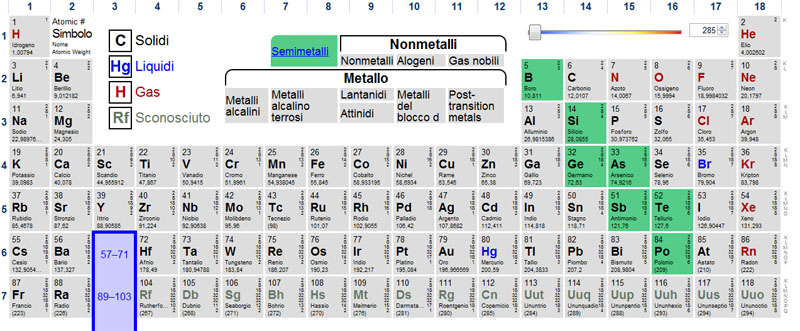
Come si può intuire dal nome si tratta di elementi che hanno caratteristiche intermedie tra i metalli e i non metalli, si tratta in partica di soli sette elementi: Boro, Silicio, Germanio, Arsenico, Antimonio, Tellurio e Polonio.
NON METALLI
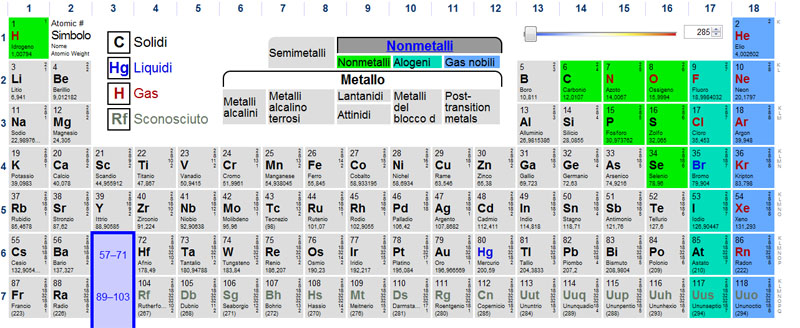
Quelli evidenziati con i colori qui sopra sono invece i non metalli, come vedete sono decisamente in minoranza rispetto ai metalli.
Quattro tra questi elementi sono basilari per noi esseri viventi, idrogeno, carbonio, azoto e ossigeno costituiscono la maggior parte delle molecole organiche, il nostro corpo ad esempio è formato in gran parte proprio da questi quattro elementi.
L'ossigeno e l'idrogeno sono tra i più reattivi elementi anche nella chimica inorganica ed entrano in un gran numero di composti. Tra i non metalli da ricordare sono gli alogeni e i gas nobili
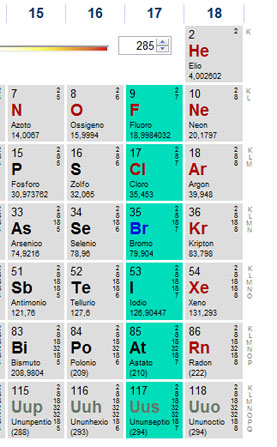
ALOGENI
Fluoro (F)
Cloro (Cl)
Bromo (Br)
Iodio (I)
Astato (At)
|
 |
|
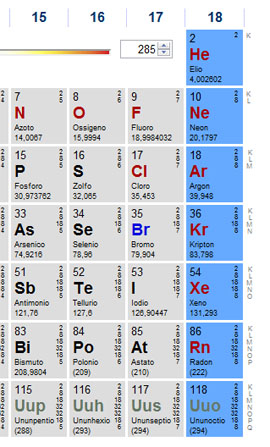
GAS NOBILI
Elio (He)
Neon (Ne)
Argon (Ar)
Kripton (Kr)
Xenon (Xe)
Radon (Rn) |
OK, INIZIAMO A MESCOLARE...
OSSIDI =
OSSIGENO + ALTRO ELEMENTO
OSSIGENO + METALLO (ossidi basici)
Sono gli ossidi metallici, ad esempio il ferro forma tre diversi composti.
Ora, tanto per complicare le cose succede spesso che uno stesso composto possa presentarsi con nomi diversi. Il "nome ufficiale" è il nome IUPAC. La IUPAC, acronimo di International Union of Pure and Applied Chemistry (in italiano Unione Internazionale di Chimica Pura ed Applicata), è una organizzazione non governativa che si occupa, tra le altre cose, di stabilire in modo univoco e semplice, i nomi per tutte le sostanze chimiche. Ad esempio, la magnetite si chiama tetraossdio di triferro secondo la nomenclatura IUPAC, ossido ferroso ferrico, secondo la nomenclatura tradizionale e con il nome comune di magnetite.
Noi ci atterremo di solito al nome IUPAC, ma talvolta potrebbe essere utile conoscere anche il nome tradizionale o il nome comune.
Ecco alcuni esempi: tra parentesi il nome tradizionale, in corsivo eventuale nome comune
FeO Monossido di ferro (ossido ferroso)
Fe2O3 Triossido di diferro
(ossido ferrico) ruggine
Fe3O4
Tetraossido di triferro, Ferro (II, III) ossido, (ossido ferroso ferrico) magnetite
PbO2 Biossido di piombo
ZnO Ossido di zinco
CaO Ossido di calcio, calce viva
Na2O Ossido di disodio (Ossido disodico)
OSSIGENO + SEMIMETALLO
SiO2 Biossido di silicio, silice
OSSIGENO + NON METALLO (ossidi acidi)
Questi ossidi, a differenza dei precedenti, si presentano solitamente gassosi a temperatura ambiente e nella nomenclatura tradizionale (ancora molto usata) prendono il nome di anidridi.
CO Monossido di carbonio
CO2 Diossido di carbonio (anidride carbonica)
SO Monossido di zolfo
SO2 Diossido di zolfo (anidride solforosa)
SO3Triossido di zolfo (anidride solforica)
Cl2O Monossido di dicloro (anidride ipoclorosa)
Cl2O3 Triossido di dicloro (anidride clorosa)
Cl2O5 Pentossido di dicloro (anidride clorica)
Cl2O7 Eptossido di dicloro (anidride perclorica)
NO Ossido di azoto (ossido nitrico)
NO2 Diossido di azoto (ipoazotide)
N2O Monossido di diazoto (protossido di azoto) gas esilarante, nos
(questo composto si presta ai più svariati usi: in ambito medico viene usato per effettuare anestesie, costituisce il propellente per areosol e per le bombolette di panna spray, viene usato come comburente nei motori per razzi e è diventato famoso dopo la serie dei film "fast and furious" perché usato come additivo per aumentare la potenza dei motori a scoppio.)
N2O3 Triossido di diazoto (anidride nitrosa)
N2O5 Pentaossido di diazoto (anidride nitrica)
IDRURI
IDROGENO + ALTRO ELEMENTO (escluso gli alogeni e S)
Gli idruri sono un gruppo molto eterogeneo di composti e presentano caratteristiche anche molto diverse.
Alcuni sono solidi cristallini come
LiH Idruro di litio
MgH2 Idruro di magnesio
altri sono gassosi come gli idruri di azoto, per questi composti è ancora molto in uso la denominazione tradizionale
NH3 Triidruro di azoto, ammoniaca
N2H4 Idrazina
CH4 Idrocarburi Metano
IDROSSIDI
METALLO + GRUPPO -OH
Il gruppo OH, chiamato gruppo ossidrile è formato da un atomo di ossigeno e un atomo di idrogeno. Questo gruppo di due atomi dispone di un "legame" libero, nel senso che può "agganciare" qualche altro elemento.
NaOH Idrossido di sodio, soda caustica
KOH Idrossido di potassio, potassa caustica
Ca(OH)2 Diidrossido di calcio, (idrossido di calcio), calce spenta
Al(OH)3 Triidrossido di alluminio
Fe(OH)2 Diidrossido di ferro
LiOH Idrossido di litio
ACIDI
Sono composti chimici solubili in acqua, irritanti e in grado di intaccare alcuni metalli e alcune rocce. Man mano che ci "addentreremo" nello studio della chimica vedremo che la definizione di acido è abbastanza complessa...
IDRACIDI = IDROGENO + NON METALLO (solitamente un alogeno e lo zolfo)
Nella nomenclatura tradizionale ancora molto usata, questi composti prendono il nome di acido, seguito dal nome del non metallo più il suffisso "idrico"
HCl Cloruro di idrogeno (acido cloridrico) acido muriatico
HF Fluoruro di idrogeno (acido fluoridrico)
HBr Bromuro di idrogeno (acido bromidrico)
HI Ioduro di idrogeno (acido iodidrico)
H2S Solfuro di idrogeno (acido solfidrico)
OSSIACIDI = DERIVANO DALLA REAZIONE TRA UN OSSIDO ACIDO (ANIDRIDE) E L'ACQUA
Ad esempio: CO2 + H2O => H2CO3 Acido carbonico (anche per questi composti è molto usata la nomenclatura tradizionale)
H2SO4 Tetraossisolfato di bi-idrogeno (Acido solforico)
H2SO3 Triossisolfato di bi-idrogeno (Acido solforoso)
HNO3 Triossinitrato di idrogeno (Acido nitrico)
HNO2 Biossinitrato di idrogeno (Acido nitroso)
H3PO4 Tetraossifosfato di tri-idrogeno (Acido fosforico)
H3BO3 Triossiborato di tri-idrogeno (Acido borico)
Se volete dare un'occhiata a qualche altro ossiacido ecco il link per wikipedia
 ossiacidi ossiacidi
SALI
Si tratta di un gruppo di composti dalle proprietÓ molto variabili, di solito si ottengono a partire dagli acidi (vedi sopra), sostituendo gli atomi di idrogeno con dei metalli. Se il sale deriva da un idracido prende il suffisso "uro", se il sale deriva da un ossiacido il nome prende il suffisso "ato" se l'acido finiva per "ico", e "ito" se l'acido finiva per "oso". (in realtà ci sono anche altri casi, ma per adesso direi che è già abbastanza complicato in questo modo..)
ALOGENURI = METALLO + ALOGENO
NaCl Cloruro di sodio, sale da cucina
CaF2 Difluoruro di calcio, fluorite
KBr Bromuro di potassio
AgI Ioduro di argento
SOLFURI = METALLO + ZOLFO
FeS Solfuro di ferro
CuS Solfuro di rame
SALI CHE DERIVANO DA OSSIACIDI
MgSO4 Solfato di magnesio (deriva da acido solforico)
Na2SO3 Solfito di sodio (deriva da acido soforoso)
Fe2(SO4)3 Solfato di ferro
AgNO3 Nitrato di argento (deriva da acido nitrico)
NaNO2 Nitrito di sodio (deriva da acido nitroso)
Pb(NO3)2 Nitrato di piombo
CaCO3 Carbonato di calcio
Ca3(PO4)2 Fosfato di calcio
OK, COME INTRODUZIONE PUO' BASTARE!!
E' probabile che, se ce l'avete fatta ad arrivare fino in fondo, siate un po' frastornati da tutti questi nomi. Non vi preoccupate, la chimica va digerita un po' alla volta, piano piano, se continuerete a studiare, questi nomi vi diventeranno sempre più familiari... Certo senza studio e un minimo di impegno la vedo un po' dura...
Intanto per fare un po' di pratica beccatevi questo TEST
|






